國家通知:二類醫療器械監管,全國啟動
繼三類醫療器械唯一標識全面實施后,醫療器械身份證將擴圍至二類醫療器械。
目前,全國從事二類醫療器械的生產和經營企業眾多。據國家藥監局最新發布統計數據,截至2021年9月底,全國可生產第二類產品的企業1.37萬家;僅經營第二類醫療器械產品的企業達68.44萬家。諸多二類醫療器械臨床需求量大、涉及金額高。
一場新的監管風暴正在醞釀。
01第三批醫療器械唯一標識工作將啟動
11月30日,國家藥監局綜合司發布《關于做好第三批實施醫療器械唯一標識工作的公告(征求意見稿)》(以下簡稱《征求意見稿》)。
哪些品類將開展第三批實施醫療器械唯一標識工作?
《征求意見稿》指出,按照風險程度和監管需要,確定部分臨床需求量較大的一次性使用產品、列入醫保集采范圍的品種、醫療美容相關產品等部分第二類醫療器械作為第三批醫療器械唯一標識實施品種。
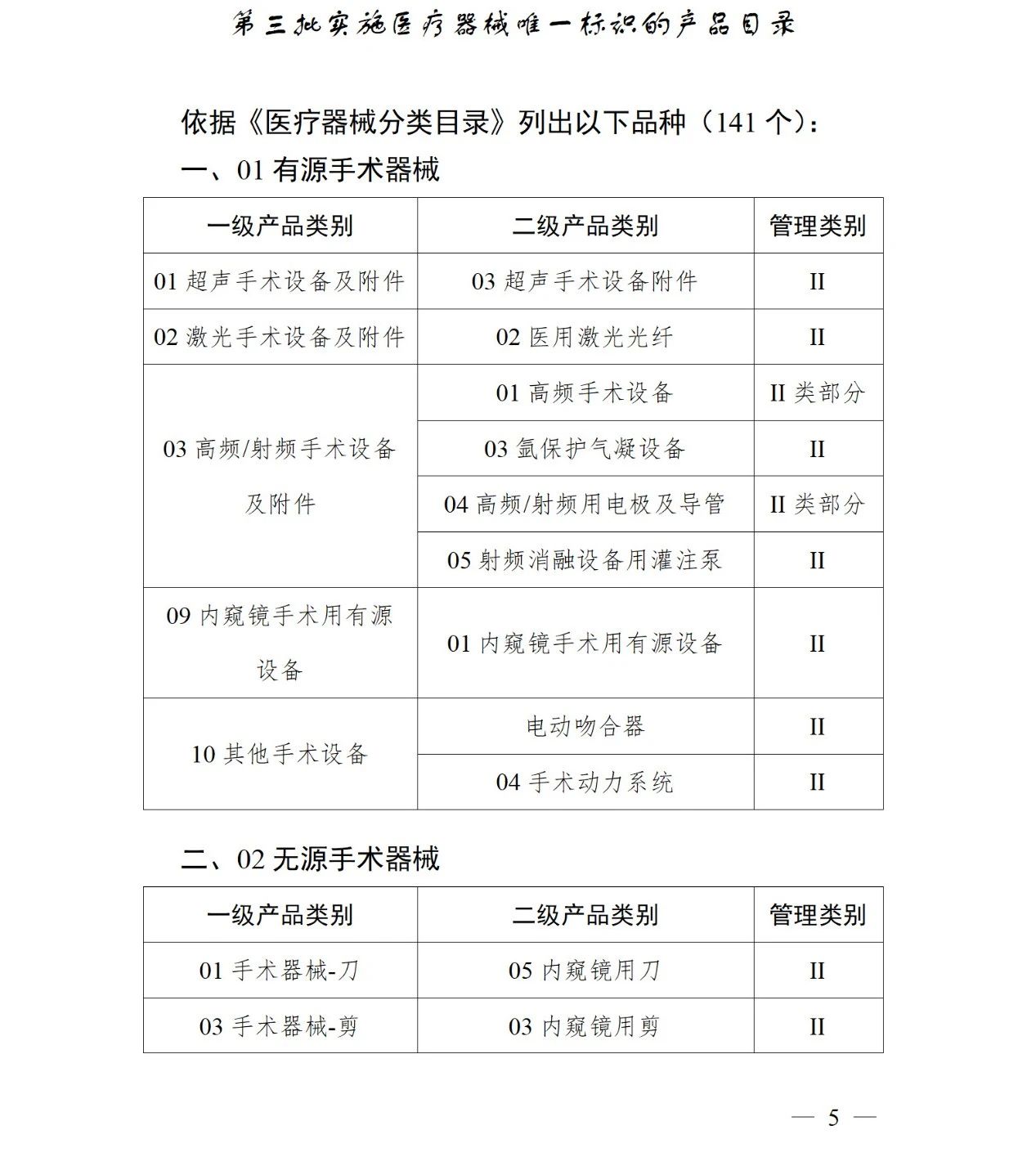
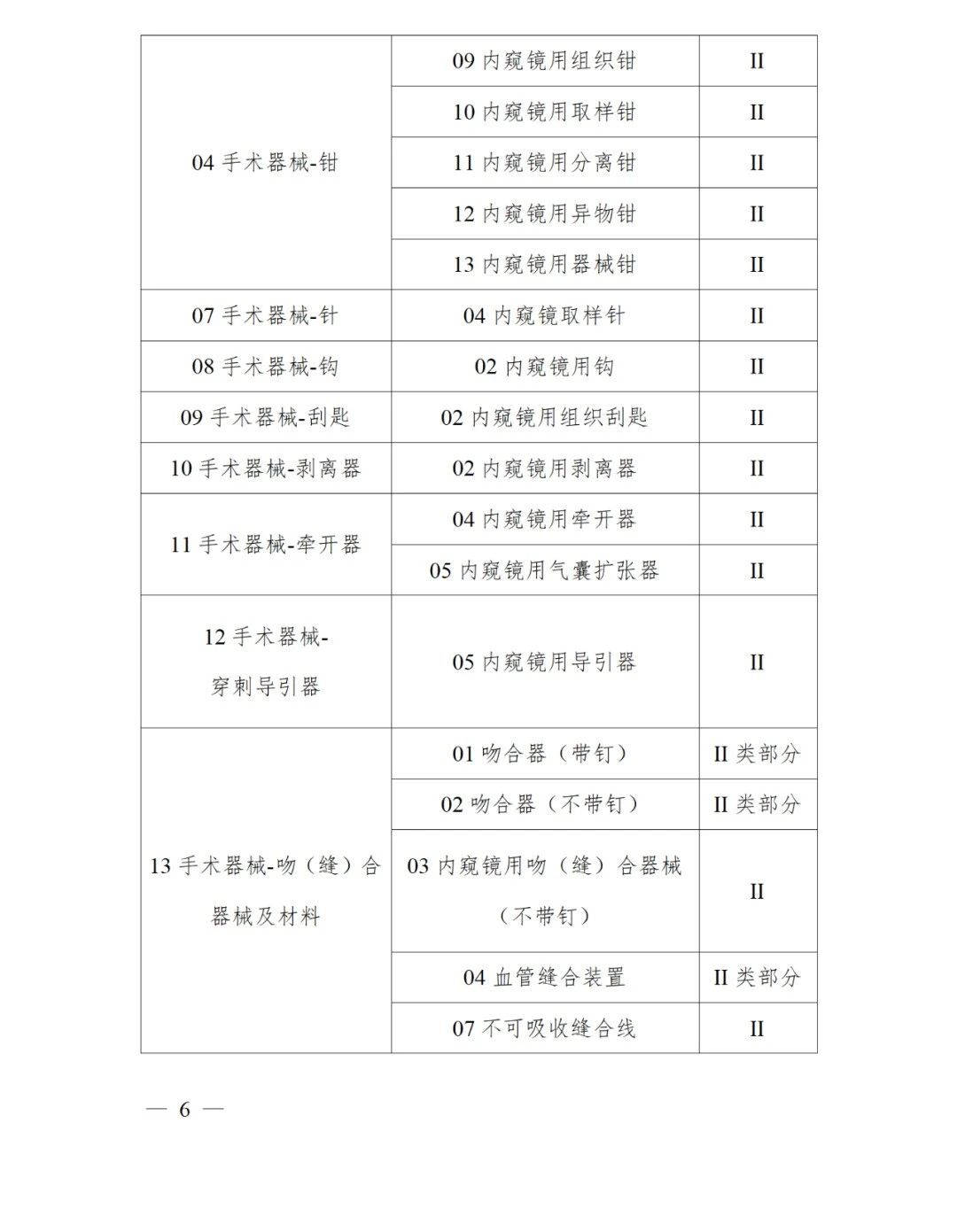
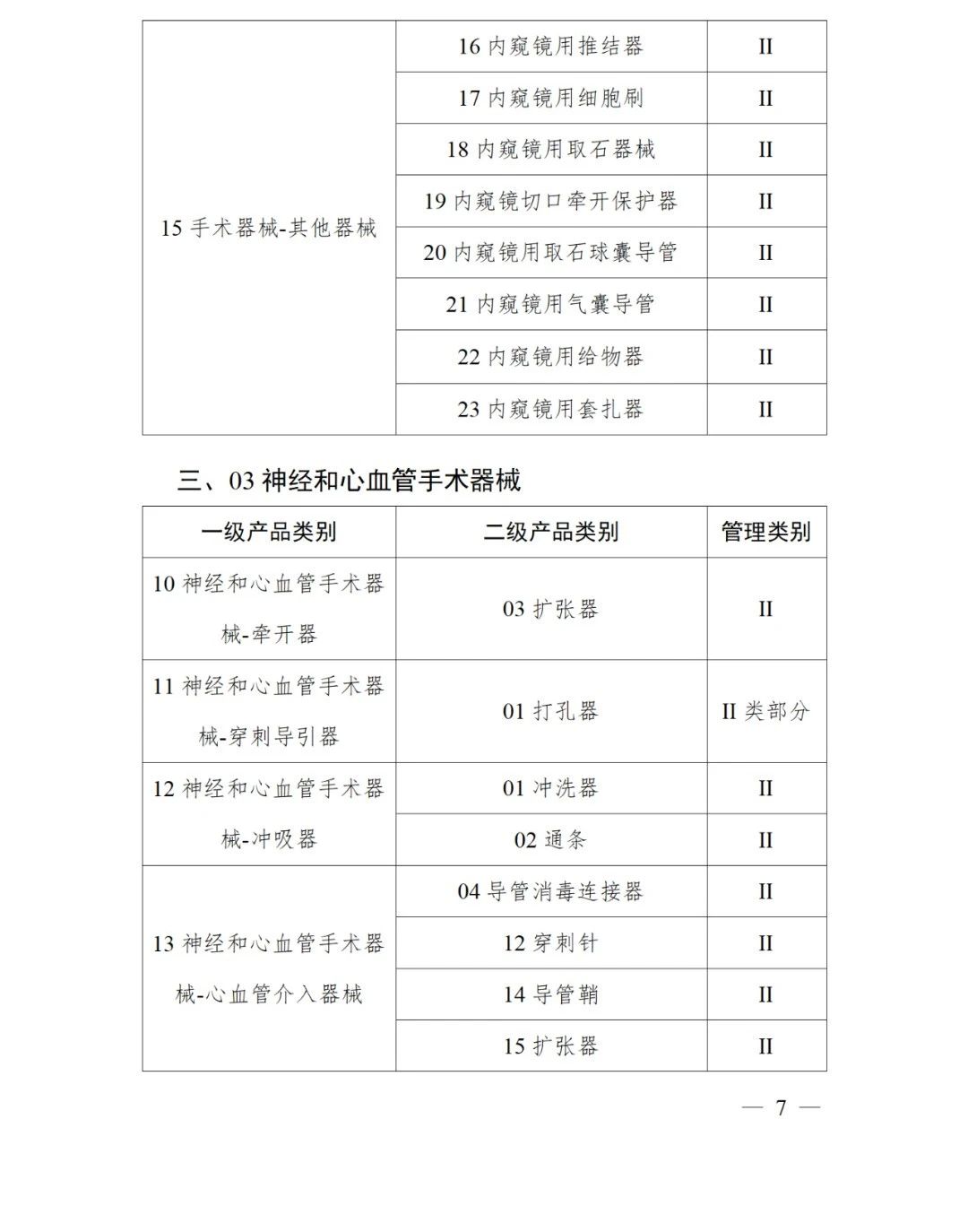
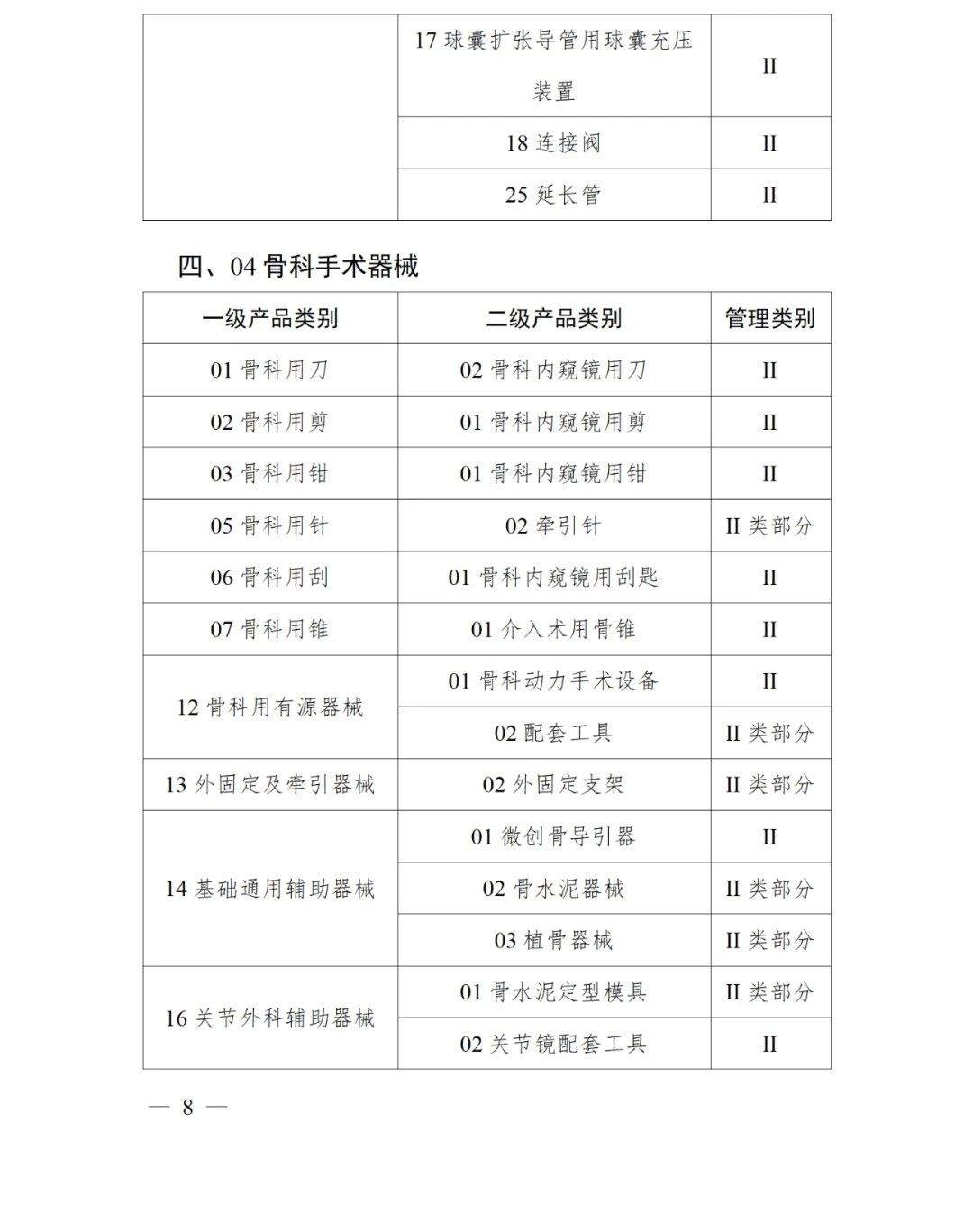
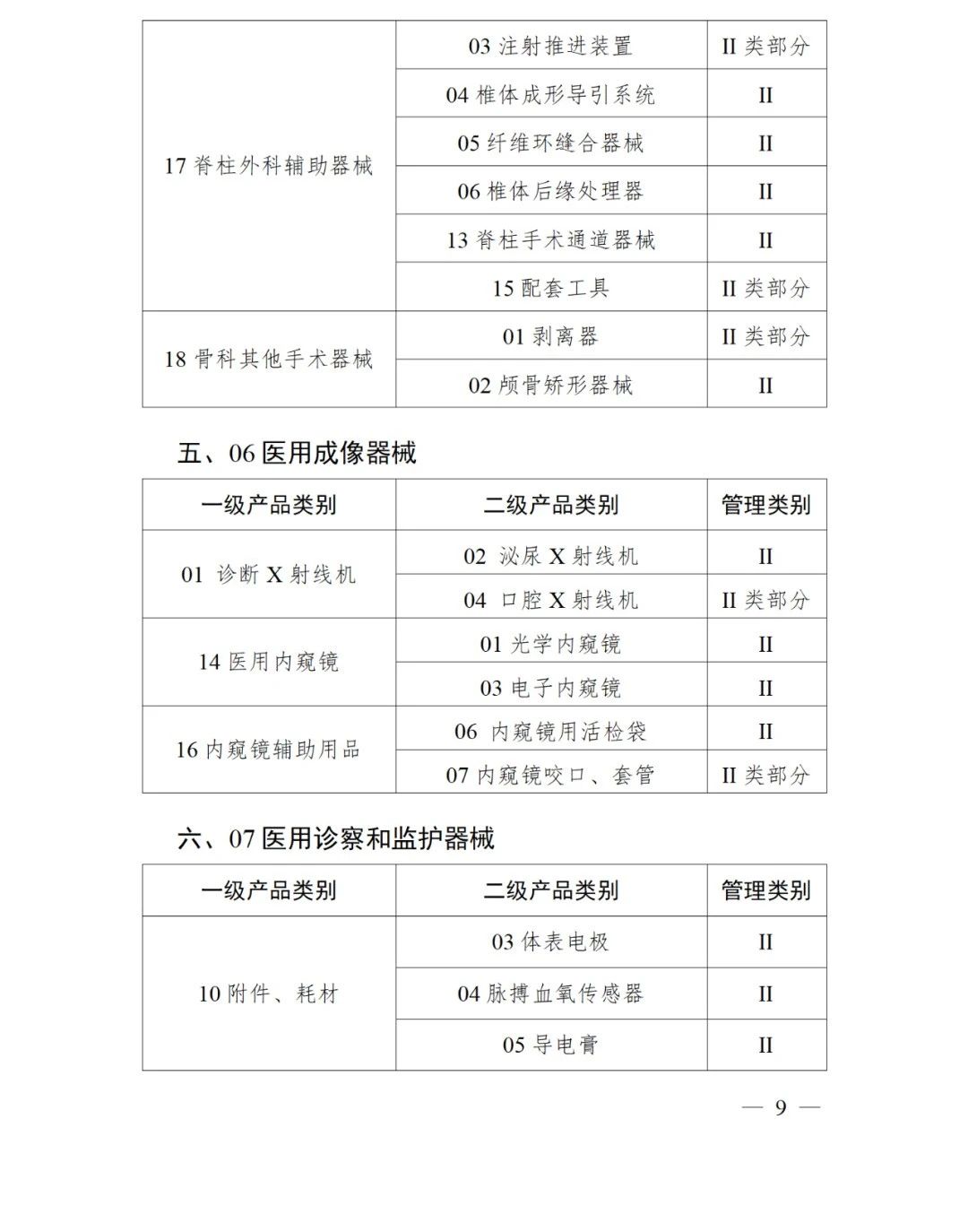
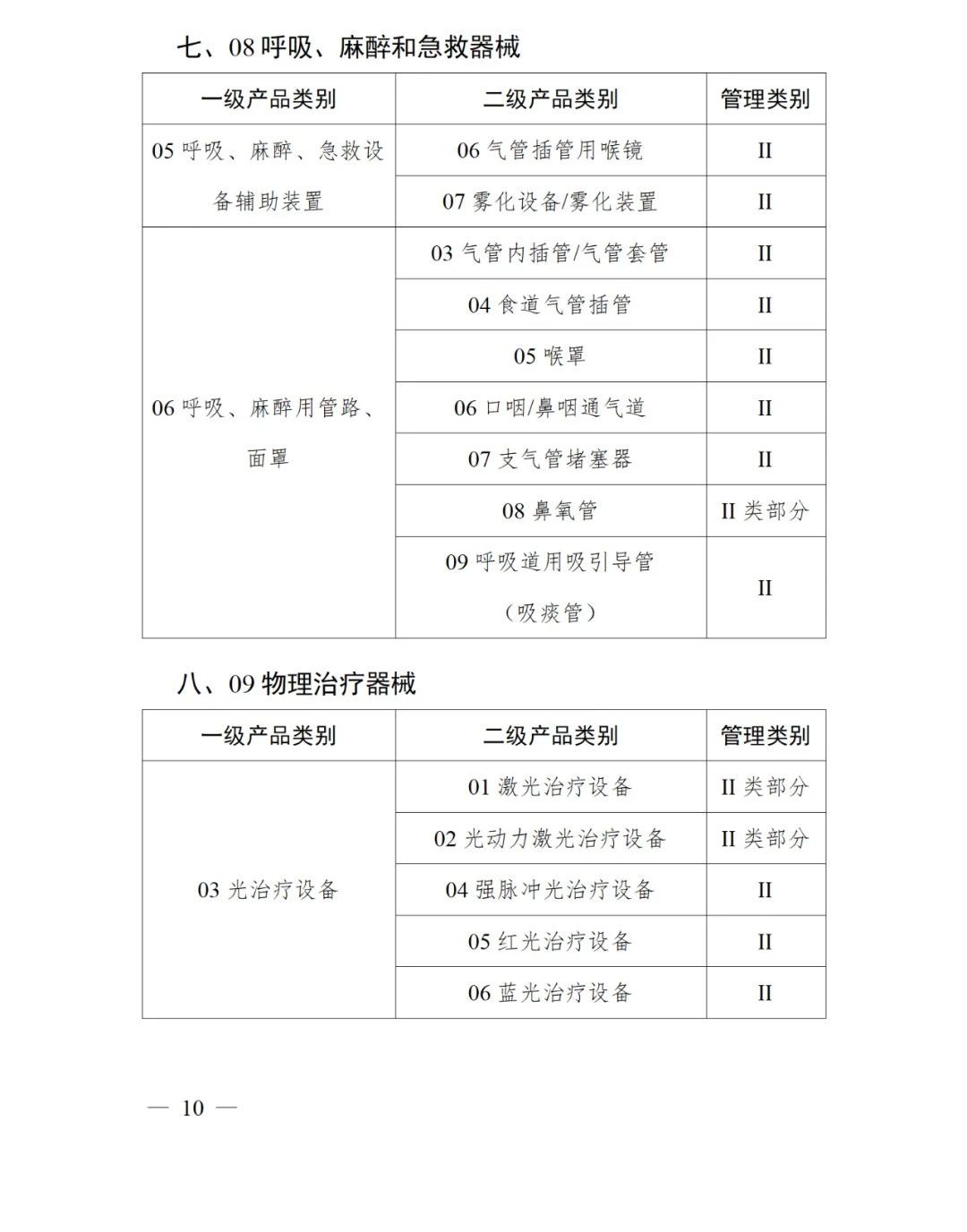
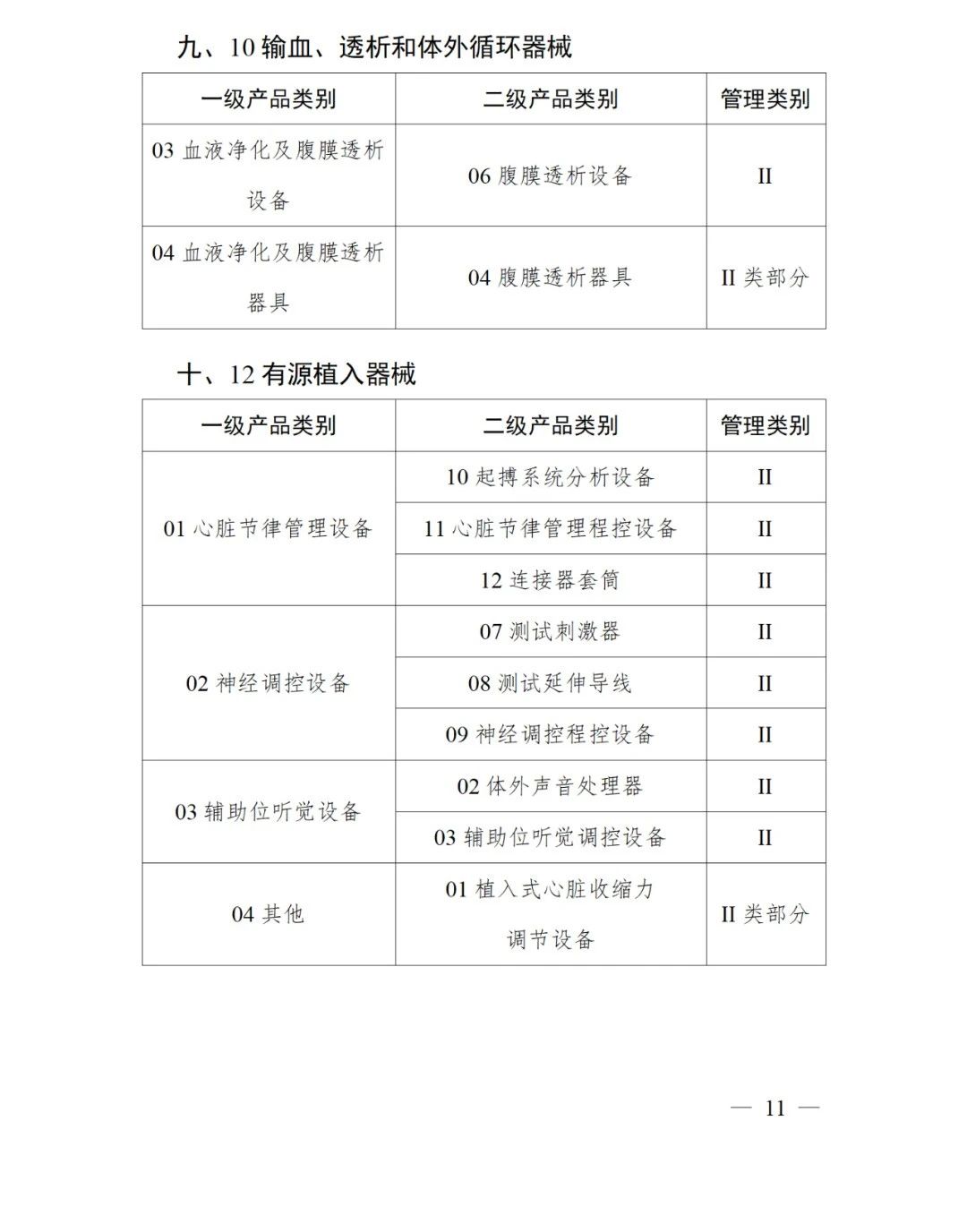
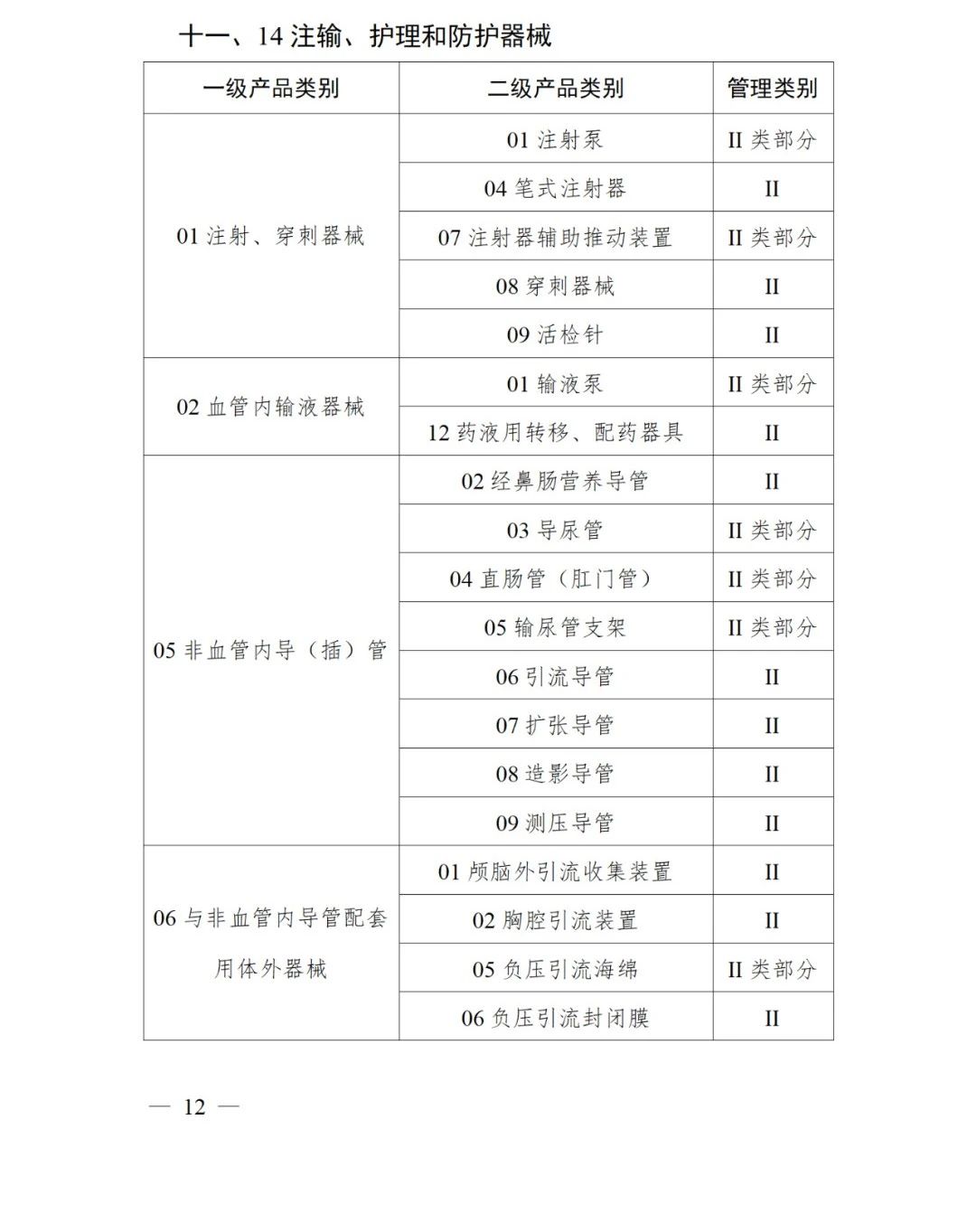
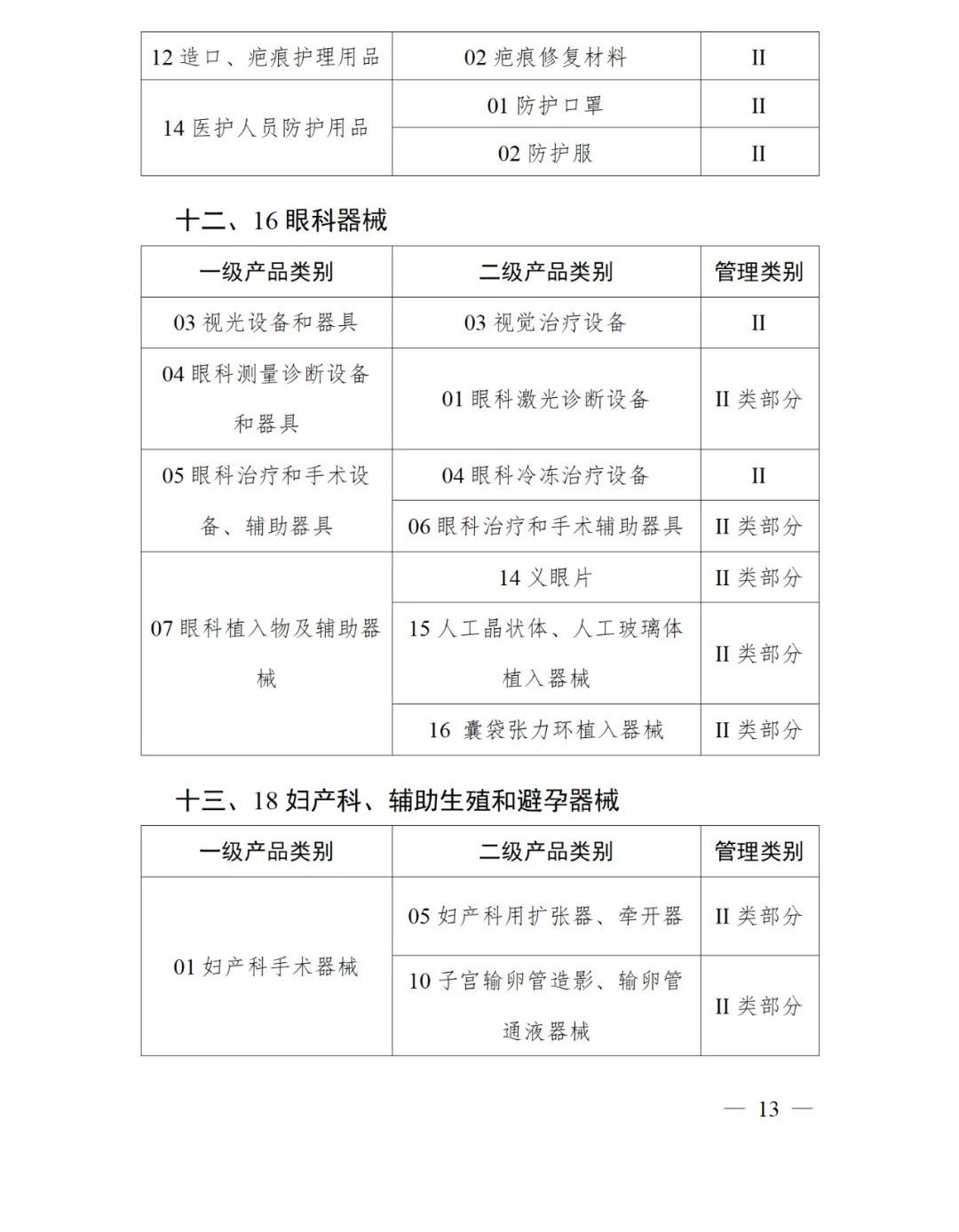
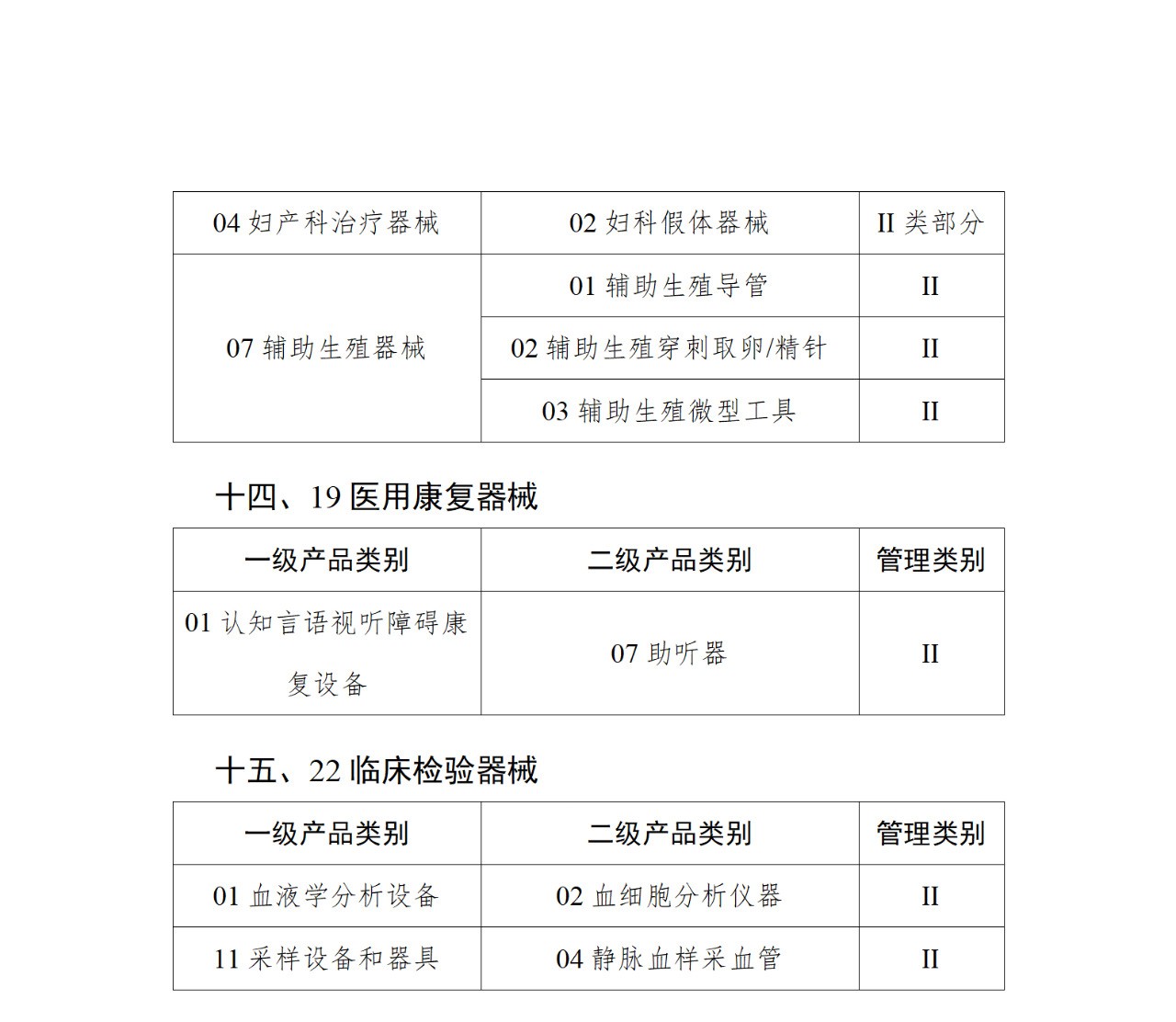
《第三批實施醫療器械唯一標識的產品目錄》中包括141種醫療器械,如超聲手術設備附件、醫用激光光纖、高頻手術設備、電動吻合器、血管縫合裝置、光學內窺鏡、電子內窺鏡、腹膜透析設備、起搏系統分析設備、活檢針、防護服、助聽器、血細胞分析儀器等。
對列入第三批實施產品目錄的醫療器械,注冊人應當注意以下幾點:
根據《征求意見稿》,2024年6月1日起生產的醫療器械應當具有醫療器械唯一標識;此前已生產的第三批實施唯一標識的產品可不具有唯一標識。生產日期以醫療器械標簽為準。
2024年6月1日起申請注冊的,注冊申請人應當在注冊管理系統中提交其最小銷售單元的產品標識;2024年6月1日前已受理或者獲準注冊的,注冊人應當在產品延續注冊或者變更注冊時,在注冊管理系統中提交其最小銷售單元的產品標識。
2024年6月1日起生產的醫療器械,在其上市銷售前,注冊人應當按照相關標準或者規范要求將最小銷售單元、更高級別包裝的產品標識和相關數據上傳至醫療器械唯一標識數據庫,確保數據真實、準確、完整、可追溯。
對于已在國家醫保局醫保醫用耗材分類與代碼數據庫中維護信息的醫療器械,要在唯一標識數據庫中補充完善醫保醫用耗材分類與代碼字段,同時在醫保醫用耗材分類與代碼數據庫維護中完善醫療器械唯一標識相關信息,并確認與醫療器械唯一標識數據庫數據的一致性。
02二類醫療器械將納入全面監管
2021年1月1日,第一批9大類69個品種開始實施醫療器械唯一標識。2022年6月1日,其他第三類醫療器械(含體外診斷試劑)全面實施醫療器械唯一標識。
以上是國家層面的統一動作。截至目前,第三類醫療器械已全面落實唯一標識。另據賽柏藍器械觀察,海南、福建、四川、北京、天津、山東、寧夏等諸多省市,也已陸續開展第二類醫療器械醫療器械唯一標識工作。
賽柏藍器械獲悉,雖然此前國家沒有明確要求二類醫療器械必須具備唯一標識,但從事二類醫療器械生產的企業,也在主動推進唯一標識。
從生產廠家的角度來看,唯一標識更有利于產品追溯。
據了解,以往許多醫療器械時常是一整批共用一個批號,如果某個產品出現問題,廠家只能追溯整個批次,但無法精確到具體產品。而醫療器械唯一標識可以使企業明確知道每個產品出廠后用在了哪里,一旦出現問題可能及時溯源,利于提升企業內部質量管理水平。
需要關注的是,今年開始施行的新版《醫療器械生產監督管理辦法》中明確,醫療器械注冊人、備案人、受托生產企業應當按照國家實施醫療器械唯一標識的有關要求,開展賦碼、數據上傳和維護更新,保證信息真實、準確、完整和可追溯。
其中規定,未按照國家實施醫療器械唯一標識的有關要求,組織開展賦碼、數據上傳和維護更新等工作的,由藥品監督管理部門依職責責令限期改正;拒不改正的,處1萬元以上5萬元以下罰款;情節嚴重的,處5萬元以上10萬元以下罰款。
而在第三批醫療器械唯一標識工作全面啟動后,更多二類醫療器械也將納入全面監管。
03全鏈條監管,監管死角被清掃
在醫療器械唯一標識的推進過程中,其與醫保編碼的對接也引起關注。
《征求意見稿》中指出,醫療器械注冊人要切實落實主體責任,鼓勵基于唯一標識建立健全追溯體系,做好產品召回、追蹤追溯等有關工作。醫療器械經營企業要在經營活動中積極應用唯一標識,做好帶碼入庫、出庫,實現產品在流通環節可追溯。
醫療機構要在臨床使用、支付收費、結算報銷等臨床實踐中積極應用唯一標識,做好全程帶碼記錄,實現產品在臨床環節可追溯。
此外,省級藥品監督管理部門要加強與轄區內衛生、醫保部門協同,推動三醫聯動。省級衛生健康部門要指導轄區內醫療機構積極應用唯一標識,加強醫療器械在臨床應用中的規范管理。
省級醫保部門要加強醫保醫用耗材分類與代碼與醫療器械唯一標識的關聯使用,推動目錄準入、支付管理、帶量招標等的透明化、智能化。
多碼對接后,醫療器械全鏈條聯動監管,更多監管死角將被清掃。
今年7月,寧夏召開全區醫療器械唯一標識全環節試點啟動會。會上指出,寧夏將醫療器械唯一標識的實施鏈條,由生產、經營環節,延伸到了二級以上公立醫院等使用終端,實現了全環節覆蓋。
全面實施醫療器械唯一標識后,全區二級以上公立醫院在患者身上使用的每一件納入醫保目錄的二三類醫療器械,均可通過信息化手段追溯至該件醫療器械的生產商、經銷商、供應商。
醫療器械身份證全面落地后,行業也將迎來監管新階段。
【來源:賽柏藍器械】

相關閱讀
- 2022年底上海第二類醫療器械產品注冊周期縮短至6-7個月2021-05-21
- 細化實施醫療器械GMP2015-03-06
- 醫療器械將有統一“全球身份證” 質量有問題將迅速召回2014-11-19
- 2014年我國將提高醫械監管科學化水平2014-01-26
- 食藥局成立監察員隊伍處理國際事務2012-07-13






