2017年飛檢開始 6省6家醫療器械企業已被查
發布時間:2017/4/12 13:34:05
由國家藥監總局組織的2017年度醫療器械飛行檢查工作已經開始了。
4月11日,藥監總局通報了對6家醫療器械生產企業的飛行檢查情況,檢查時間均在今年3月底,受查企業分布在6個不同省份,其中5家為IVD企業,1家為無菌醫療器械生產企業,所查均為醫械GMP合規情況,檢查結果則均為限期整改。
另外,今年2月27日時,藥監總局食品藥品審核查驗中心才發布公告,稱經過綜合考評后聘任45人為第二批國家醫療器械檢查員。而從4月11日的通報來看,第二批國家檢察員已經行動了,部分人早已參與到3月底的飛行檢查工作中。
再按照此前披露消息,今年藥監總局一共計劃本級飛檢50-80家械企,包括兩類:高風險產品生產企業;由總局直接辦理案件中涉及的生產企業。除了已經被查的6家企業,接下來,還有幾十家企業也將迎來總局飛檢了。
以下為今年率先被查的6家企業各自問題情況:
1、浙江東甌診斷產品有限公司
產品類別:體外診斷試劑
主要缺陷和問題:



2、云南德華生物藥業有限公司
產品類別:無菌醫療器械
主要缺陷和問題:



3、同昕生物技術(北京)有限公司
產品類別:體外診斷試劑
主要缺陷和問題:



4、上海之江生物科技股份有限公司
產品類別:體外診斷試劑
主要缺陷和問題:



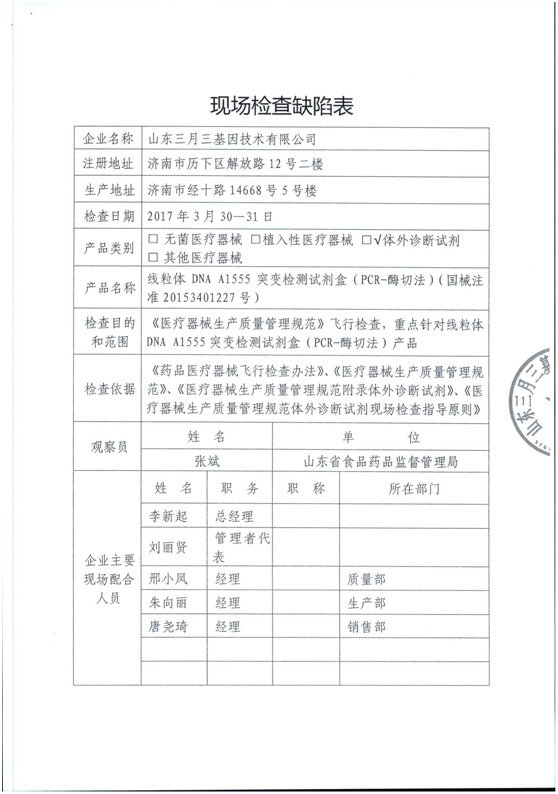
5、山東三月三基因技術有限公司
產品類別:體外診斷試劑
主要缺陷和問題:



6、湖北朗德醫療科技有限公司
產品類別:體外診斷試劑
主要缺陷和問題:



【來源:國家食品藥品監督管理總局】

相關閱讀
- 食品藥品監管總局發布《藥品醫療器械飛行檢查辦法》2015-07-09






