近期20批醫械召回,19品牌上榜!
11月7日,上海藥監局發布20起醫療器械產品召回公告。
此次召回包括2項I級召回,11項II級召回,7項III級召回。其中,2項I級召回涉及的分別為庫克的親水涂層導絲和奧林巴斯的電子十二指腸鏡。
此外,此次實施主動召回的有2家為國內醫療器械企業的國產產品。
1、奧林巴斯貿易(上海)有限公司
生產企業:奧林巴斯醫療株式會社
召回產品:電子十二指腸鏡
召回原因:公司收到來自美國市場關于電子十二指腸鏡發生病人感染病毒的投訴信息。經調查,這可能與電子十二指腸鏡清洗消毒不徹底有關。
銷售數量:在中國銷售數量為12件。
召回級別:Ⅰ
2、賓得醫療器械(上海)有限公司
生產企業:HOYA株式會社
召回產品:電子十二指腸內窺鏡
召回原因:部分電子十二指腸鏡結構復雜,如果未能按照使用說明書指示進行清洗和消毒,會導致污染未能及時被清除,增加病人感染風險。
銷售數量:在中國銷售數量為55
召回級別:Ⅱ
3、索靈診斷醫療設備(上海)有限公司
生產企業:DiaSorin Inc。
召回產品:雌二醇測定試劑盒(化學發光免疫法)
召回原因:企業發現,氟維司瓊可能與雌二醇測定試劑盒發生交叉反應,導致雌二醇檢測結果假性升高。
銷售數量:在中國銷售數量為823
召回級別:Ⅱ
4、通用(上海)醫療有限公司
生產企業:Nevdel SAS
召回產品:跟腱縫合導向器
召回原因:企業發現,涉及產品的無菌外包裝可能無法保證在聲稱的滅菌有效期內保持其密封的完整性,影響產品內包裝外表面保持無菌。
銷售數量:在中國銷售數量為142
召回級別:Ⅲ
5、眼力健(上海)醫療器械貿易有限公司
①生產企業:Abbott Medical Optlcs Inc
召回產品:聚丙烯酸脂類后房型人工晶狀體
銷售數量:在中國銷售數量為2
召回級別:Ⅱ
②生產企業:Abbott Medical Optlcs Inc
召回產品:折疊式后房丙烯酸人工晶體
銷售數量:在中國銷售數量為4。
召回級別:Ⅱ
召回原因:企業發現一臺檢驗設備故障,導致部分人工晶狀體在放行前未進行全部項目檢查。這可能導致貼有錯誤標簽的產品被放行,使用錯誤標簽的人工晶狀體可能導致潛在的非預期的術后屈光不正。
6、羅氏診斷產品(上海)有限公司
生產企業:Roche Diagnostica GnbH
召回產品:全自動氣血、電解質和生化分析儀
召回原因:企業發現,涉及產品在檢測新生兒血液樣本時,可能會由于樣本吸入測量池時延遲或樣本未完全吸入,導致后續分析軟件無法正確處理,進而得到錯誤偏低的新生兒膽紅素檢測結果。
銷售數量:在中國銷售數量為488
召回級別:Ⅱ
7、飛利浦(中國)投資有限公司
生產企業:Philips Medical Systems(Cleveland),Inc
召回產品:X射線計算機體層攝影設備、X射線計算機斷層攝影設備
召回原因:企業發現在執行高分辨率頭部掃描時,所重建的圖像可能會出現圖像質量降質。
銷售數量:在中國銷售數量為118
召回級別:Ⅲ
8、強生(上海)醫療器材有限公司
生產企業:Blosense Webster(Israel)Ltd
召回產品:電生理導航系統
召回原因:發現有兩個特定批次產品可能存在包裝混淆,導致產品實際尺寸與包裝標識不一致。
銷售數量:在中國銷售數量為54。
召回級別:Ⅱ
9、施樂輝醫用產品國際貿易(上海)有限公司
生產企業:Smith & Nephew,Inc
召回產品:半髖關節假體組件
召回原因:由于生產過程中的錯誤,受影響產品的卡環溝槽位置尺寸超出產品設計要求,可能影響產品正常使用。
銷售數量:在中國銷售數量為1001
召回級別:Ⅱ
10、碧迪醫療器械(上海)有限公司
生產企業:Becton,Dickins on and Company
召回產品:動脈采血器
召回原因:公司發現部分產品無菌包裝開裂,不能保證產品無菌。公司主動召回相關產品,通知相關單位收回受影響產品。
銷售數量:在中國銷售數量為19500
召回級別:Ⅱ
11、庫克(中國)醫療貿易有限公司(變更召回等級)
生產企業:Cook Incorporated
召回產品:親水涂層導絲
召回原因:公司將親水涂層導絲召回等級由二級升級為一級
銷售數量:在中國銷售數量為331
召回級別:Ⅰ
12、柯惠醫療器材國際貿易(上海)有限公司
生產企業:Covidien 11c
召回產品:呼吸回路
召回原因:公司發現實際進口到中國的呼吸回路產品與當時注冊產品存在部分材質上的差異,不符合法規要求。
銷售數量:在中國銷售數量為11
召回級別:Ⅲ
13、邁柯唯(上海)醫療設備有限公司
生產企業:MAQUET GmbH
召回產品:手術床系統
召回原因:公司發現制造適配器的材料未能達到公司規定的要求,不符合產品設計強度要求,影響患者使用安全。
銷售數量:在中國銷售數量為3
召回級別:Ⅲ
14、貝朗醫療(上海)國際貿易有限公司
生產企業:B.Braun Melsungen AG
召回產品:一次性使用連續腰麻導管套件
召回原因:公司內部檢測發現涉及產品的聚氯乙烯膜可能有空隙,影響無菌屏障系統。公司決定召回相關產品,向用戶發出通知,凍結庫存產品,回收客戶未使用產品。
銷售數量:在中國銷售數量為5800
召回級別:Ⅱ
15、貝克曼庫爾特商貿(中國)有限公司
生產企業:Beckman Coulter,Inc
召回產品:總鐵結合力樣本預處理柱試劑盒
召回原因:企業發現,總鐵結合力樣本預處理柱試劑盒的注冊證、中文說明書和中文標簽中的存儲溫度與英文標簽中標注的存儲溫度不一致。
銷售數量:在中國銷售數量為3179
召回級別:Ⅲ
16、飛利浦(中國)投資有限公司
生產企業:Phiiips Medical SYStems
召回產品:病人監護儀
召回原因:當本地設置為“報警開啟”的出廠默認設定修改后,涉及產品將禁止ECG報警生成并傳輸至PhilipsIntelliVue信息中心PIICiX,并且PIICiX上不會顯示ECG報警已禁用。
銷售數量:在中國銷售數量為150
召回級別:Ⅱ
17、伯樂生命醫學產品(上海)有限公司
生產企業:Bio-Rad Laboratories,Inc
召回產品:凝血質控物
召回原因:凝血質控物水平1,可能無法滿足說明書上所示的開瓶后存放在2-25度的要求。
銷售數量:在中國銷售數量為3607
召回級別:Ⅲ
18、上海衛康光學眼鏡有限公司
生產企業:上海衛康光學眼鏡有限公司
召回產品:軟性親水接觸鏡
召回原因:企業收到《國家醫療器械抽驗產品檢驗結果送達告知書》,涉及產品“總直徑”不合格。
銷售數量:在中國銷售數量為1644
召回級別:Ⅲ
19、捷邁(上海)醫療國際貿易有限公司
生產企業:Zimmer Spine
召回產品:椎間融合器輔助工具
召回原因:產品說明書所列的清洗和去污方法,不能保證產品徹底清洗和去污,可能導致病人感染危險。
銷售數量:在中國銷售數量為0
召回級別:Ⅱ
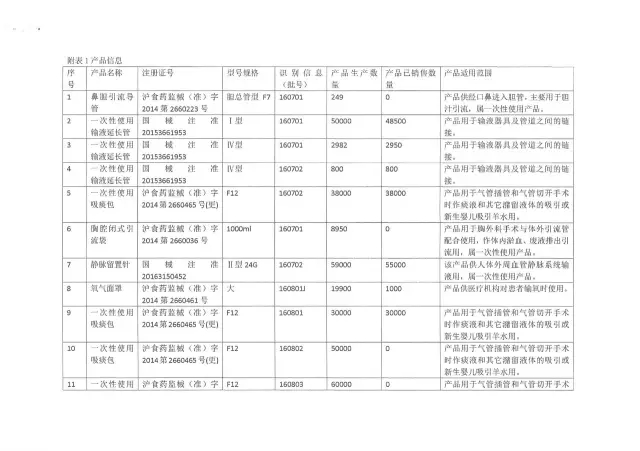
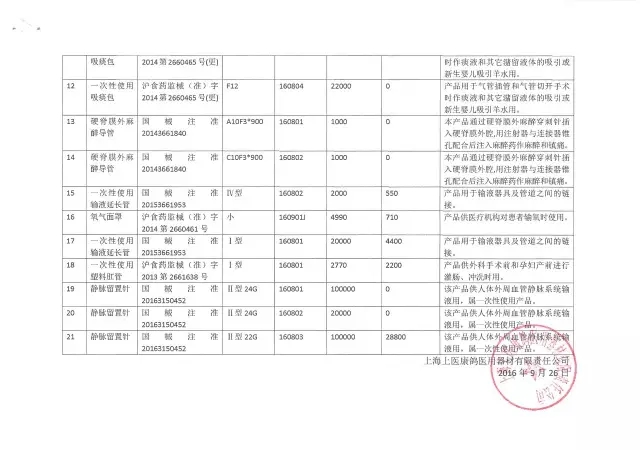
20、上海上醫康鴿醫用器材有限責任公司
生產企業:上海上醫康鴿醫用器材有限責任公司
召回產品:部分滅菌后產品
召回原因:企業滅菌柜控制軟件更新升級,滅菌參數做了調整,但企業未對滅菌過程進行再確認,不能保證滅菌產品無菌
銷售數量:(點擊查看大圖)
召回級別:Ⅱ
【來源:醫療口碑整理自上海藥監局】

相關閱讀
- 10家醫療器械公司召回了過萬件產品2018-10-31
- 關于醫療器械“召回” 你還應該了解這些2018-08-07
- 上海市醫療器械召回,國產數量在增多2018-07-25
- 一大波召回來襲 醫療器械召回新規發威了!2017-05-10
- 醫療器械召回管理辦法落地 徹底影響械企!2017-05-02






